|
- MENU -






|

1. 一次電池 (Primary Battery)
一次電池と二次電池の違い
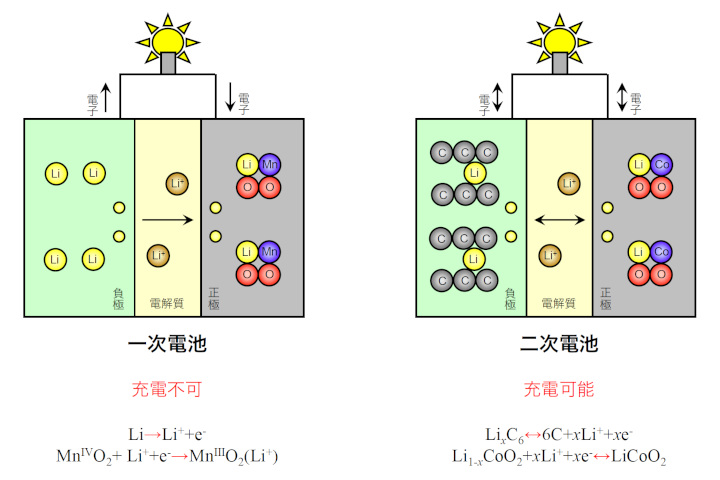
|
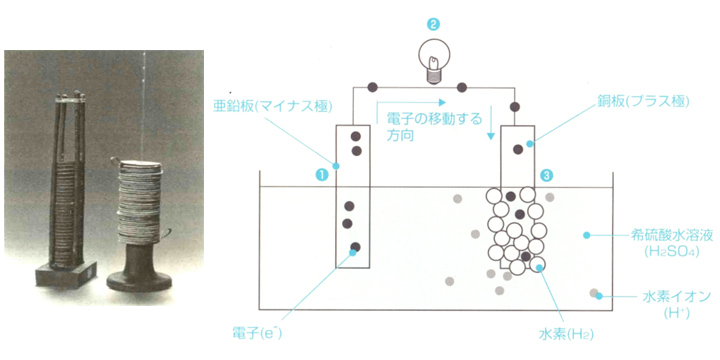
1.1 ボルタ電池 (Voltaic Battery)
|
| 負極(−極)化学反応式 |
電解質 |
正極(+極)化学反応式 |
電圧 |
| Zn→Zn2++2e- |
H2SO4 |
2H++2e-→H2 |
1.1V |
|
- 1800年にボルタが発明。電極のイオン化傾向の違いを利用。
- 発生水素により、+極が失活。
|
|
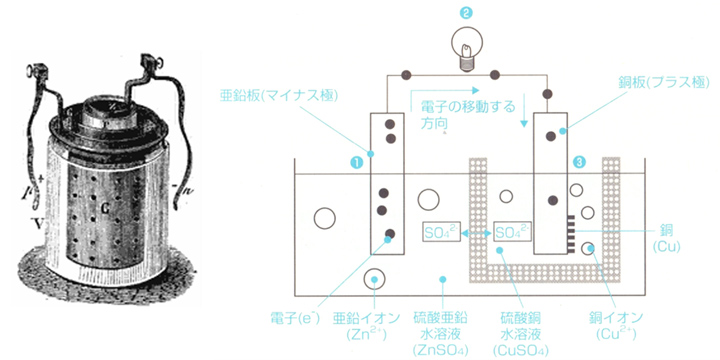
1.2 ダニエル電池 (Daniell Battery)
|
| 負極(−極)化学反応式 |
電解質 |
正極(+極)化学反応式 |
電圧 |
| Zn→Zn2++2e- |
ZnSO4, CuSO4 |
Cu2++2e-→Cu |
1.1V |
|
- 1836年にダニエルがボルタ電池を改良。
- 素焼き板(イオン交換膜)を利用することによって、+極での硫酸イオンの飽和を抑制。
|
|
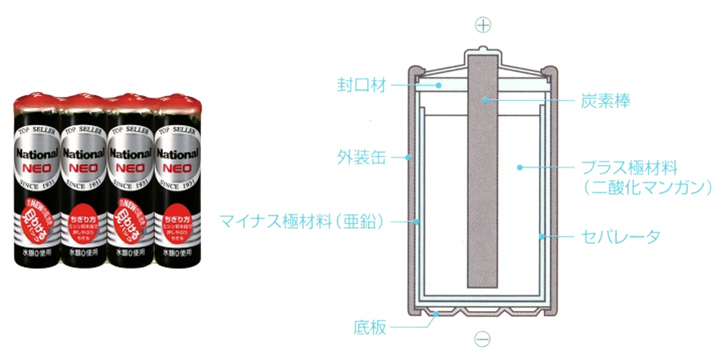
1.3 マンガン電池 (Zinc-Carbon Battery)
|
| 負極(−極)化学反応式 |
電解質 |
正極(+極)化学反応式 |
電圧 |
| 4Zn+ZnCl2+8H2O→ZnCl·4Zn(OH)2+8H++8e- |
ZnCl2 |
8Mn2O+8H++8e-→8MnOOH |
1.5V |
|
- ルクランシェ電池の改良版。電解質をNH4Cl液からZnCl2ペーストに変えることで乾電池を実現。
- 小電流、間欠放電に適する。
|
|
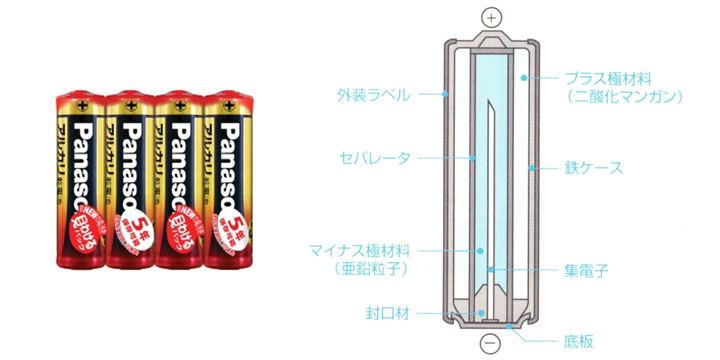
1.4 アルカリ電池 (Alkaline Battery)
|
| 負極(−極)化学反応式 |
電解質 |
正極(+極)化学反応式 |
電圧 |
| Zn+2OH-→ZnO+H2O+2e- |
KOH |
2Mn2O+2H2O+2e-→2MnOOH+2OH- |
1.5V |
|
- 1960年に製造開始。
- 電解質に水酸化カリウムを用いることによって、大電流化,大容量化を実現。
|
|
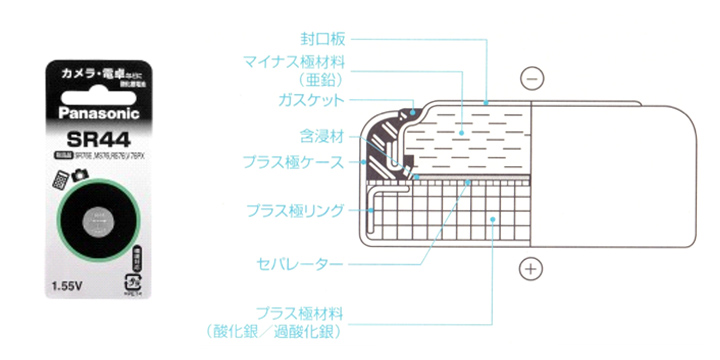
1.5 酸化銀電池 (Silver-Oxide Battery)
|
| 負極(−極)化学反応式 |
電解質 |
正極(+極)化学反応式 |
電圧 |
| Zn+2OH-→ZnO+H2O+2e- |
KOH |
Ag2O+H2O+2e-→2Ag+2OH- |
1.55V |
|
- 1976年に製造開始。
- +極に二酸化マンガンの代わりに酸化銀を使用。腕時計の電源などで利用。
|
|
1.6 リチウム一次電池 (Lithium Battery)
|
| 負極(−極)化学反応式 |
電解質 |
正極(+極)化学反応式 |
電圧 |
| Li→Li++e- |
LiBF4, LiClO4 |
(CF)n+nLi++ne-→nC+nLiF |
3.0V |
| MnIVO2+Li++e-→MnIIIO2(Li+) |
| LiAlCl4 |
2SOCl2+4Li++4e-→4LiCl+S+SO2 |
3.6V |

|
- 1976年に製造開始。
- +極の種類によって、フッ化黒鉛,二酸化マンガン,塩化チオニル各リチウム電池に分類される。
- 電解質が非水系であるため、低温でも使用可能。
|
2. 二次電池 (Secondary Battery)
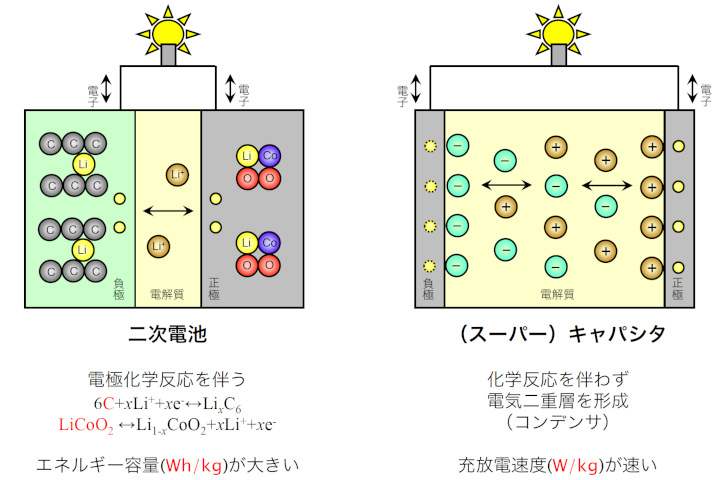
二次電池(蓄電池)と(スーパー)キャパシタの違い
|
2.1 鉛蓄電池 (Pb Battery)
|
| 負極(−極)化学反応式 |
電解質 |
正極(+極)化学反応式 |
電圧 |
| Pb+SO42-→PbSO4+2e- |
H2SO4 |
PbO2+4H++SO42-+2e-→PbSO4+2H2O |
2.0V |

|
- 1859年にブランテが発明。現在まで基本的な構造は変わっていない。
- コストが最も安価で、自動車から無停電電源装置(UPS)まで幅広く利用されている。
|
|
2.2 ニカド電池,ニッケル水素電池 (Ni-Cd, Ni-H Battery)
|
| 負極(−極)化学反応式 |
電解質 |
正極(+極)化学反応式 |
電圧 |
| Cd+2OH-→Cd(OH)2+2e- |
KOH |
NiOOH+H2O+e-→Ni(OH)2+OH- |
1.2V |
| MH+OH-→M+H2O+e- |

|
- 1899年にユングナーがニカド電池を発明、1990年よりニッケル水素電池の製造を開始。
- ハイブリッド自動車などで利用されている。
- メモリー効果がある。
|
|
2.3 リチウムイオン二次電池 (Li-ion Battery)
|
| 負極(−極)化学反応式 |
電解質 |
正極(+極)化学反応式 |
電圧 |
| CLix→C+xLi++xe- |
LiPF6, LiBF4 |
Li1-xCoO2+xLi++xe-→LiCoO2 |
3.6V |

|
- 1991年に製造開始。
- 携帯電話やノートパソコンの電源など幅広く利用されている。
- エネルギー密度が高く、今後電気自動車などへの適用が進むことが予測される。
- メモリー効果がほとんどない。
- 過充電,過放電により発火しやすく保護回路が必要。
|
|
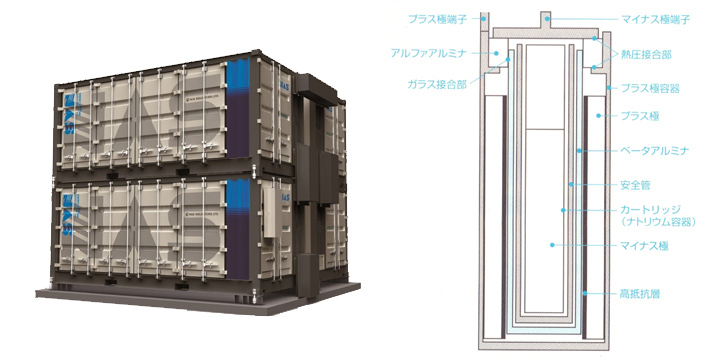
2.4 ナトリウム硫黄電池 (NaS Battery)
|
| 負極(−極)化学反応式 |
電解質 |
正極(+極)化学反応式 |
電圧 |
| 2Na→2Na++2e- |
β-Al2O3 |
5S+2Na++2e-→Na2S5 |
1.6V |
|
- 約300℃で作動。
- 出力密度は低いもののエネルギー密度が高く、負荷平準化に適している。
|
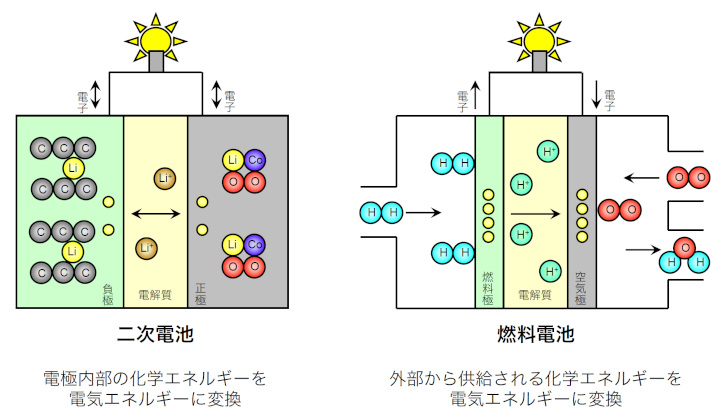
3. 燃料電池 (Fuel Cell)
二次電池と燃料電池の違い
|
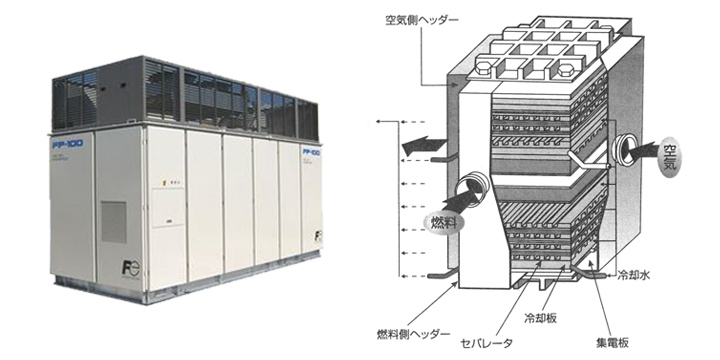
3.1 リン酸形燃料電池 (PAFC; Phosphoric Acid Fuel Cell)
|
| 燃料極(−極)化学反応式 |
電解質 |
空気極(+極)化学反応式 |
電圧 |
| H2→2H++2e- |
H3PO4 |
1/2O2+2H++2e-→H2O |
1.2V |
|
- 約200℃で作動。イオン伝導種がH+であり、燃料として純水素を使用。
- 業務用コージェネレーション(熱電併給)システム(100kW)として商品化。
|
|
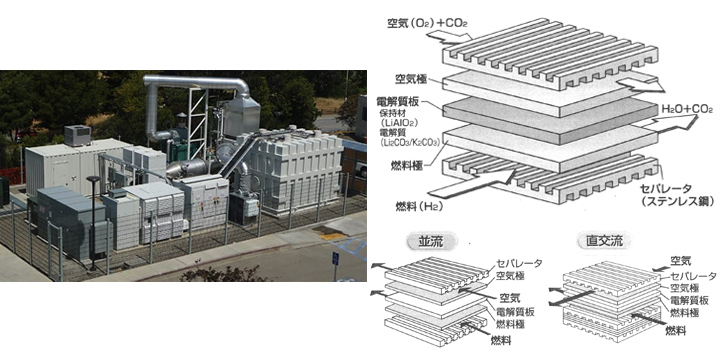
3.2 溶融炭酸塩形燃料電池 (MCFC; Molten Carbonate Fuel Cell)
|
| 燃料極(−極)化学反応式 |
電解質 |
空気極(+極)化学反応式 |
電圧 |
| H2+CO32-→H2O+CO2+2e- |
K2CO3, Li2CO3 |
1/2O2+CO2+2e-→CO32- |
1.1V |
|
- 約650℃で作動し、電解質の炭酸塩を溶融して使用。イオン伝導種はCO32-。
- 産業用分散電源(1500kW)として、主に海外で商用化。
|
|
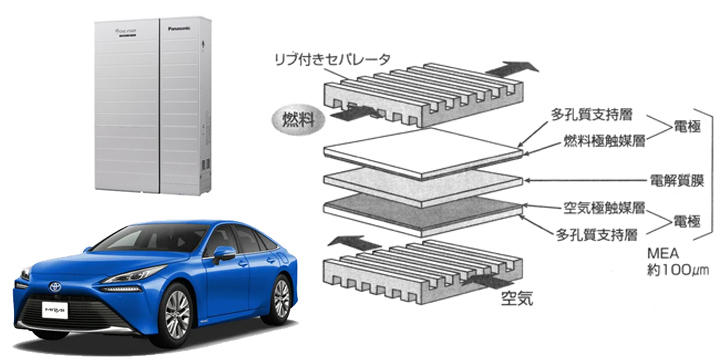
3.3 固体高分子形燃料電池 (PEFC; Polymer Electrolyte Fuel Cell)
|
| 燃料極(−極)化学反応式 |
電解質 |
空気極(+極)化学反応式 |
電圧 |
| H2→2H++2e- |
フッ素系高分子膜 |
1/2O2+2H++2e-→H2O |
1.2V |
|
- 室温〜約80℃で作動。イオン伝導種がH+であり、燃料として純水素を使用。
- 家庭用コージェネレーション(熱電併給)システム(0.7kW),自動車用(100kW)で利用。
|
|
3.4 固体酸化物形燃料電池 (SOFC; Solid Oxide Fuel Cell)
|
| 燃料極(−極)化学反応式 |
電解質 |
空気極(+極)化学反応式 |
電圧 |
| H2+O2-→2H2O+2e- |
Y2O3-ZrO2 |
1/2O2+2e-→O2- |
1.1V |

|
- 約700〜800℃の高温で作動するが、電解質は固体のセラミックス(酸化物)。
- イオン伝導種がO2-であるため、水素以外にメタン,LPG等の炭化水素も燃料として使用可能。
- 家庭用(0.7kW),業務用(200kW)コージェネレーション(熱電併給)システムとして商品化。
|
参考文献
- 松下電池工業「図解入門よくわかる最新電池の基本と仕組み」(秀和システム)
- 池田 宏之助「燃料電池のすべて」(日本実業出版社)
|
![]()